新聞中心
來(lái)源:國(guó)家藥監(jiān)局
2018年,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(以下簡(jiǎn)稱藥審中心)在國(guó)家藥品監(jiān)督管理局(以下簡(jiǎn)稱國(guó)家局)堅(jiān)強(qiáng)領(lǐng)導(dǎo)下,繼續(xù)貫徹落實(shí)中共中央辦公廳、國(guó)務(wù)院辦公廳《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見(jiàn)》(廳字〔2017〕42號(hào),以下簡(jiǎn)稱42號(hào)文件)和國(guó)務(wù)院《關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見(jiàn)》(國(guó)發(fā)〔2015〕44號(hào),以下簡(jiǎn)稱44號(hào)文件)精神,按照4月12日和6月20日國(guó)務(wù)院常務(wù)會(huì)議要求,在鼓勵(lì)藥物研發(fā)創(chuàng)新、提高藥品質(zhì)量、保障人民用藥安全有效可及等方面開(kāi)展了一系列工作,以高度的責(zé)任感和使命感持續(xù)深化藥品審評(píng)審批制度改革,堅(jiān)持依法依規(guī)、科學(xué)規(guī)范審評(píng),堅(jiān)決維護(hù)和促進(jìn)公眾健康。
一、藥品注冊(cè)申請(qǐng)受理情況
2018年,藥審中心受理新注冊(cè)申請(qǐng)共7336件(以受理號(hào)計(jì),下同),其中需技術(shù)審評(píng)的注冊(cè)申請(qǐng)5574件,直接行政審批(無(wú)需技術(shù)審評(píng),下同)的注冊(cè)申請(qǐng)1762件。與2017年相比,2018年藥審中心需技術(shù)審評(píng)的注冊(cè)申請(qǐng)任務(wù)受理量大幅增長(zhǎng)(較2017年增長(zhǎng)了47%),且中藥、化藥和生物制品各類藥品注冊(cè)申請(qǐng)任務(wù)受理量均有較大幅度增長(zhǎng)(較2017年分別增長(zhǎng)了30%、50%和42%)。
2018年,藥審中心受理1類創(chuàng)新藥注冊(cè)申請(qǐng)共264個(gè)品種(涉及533件受理號(hào),化藥的品種數(shù)以活性成分統(tǒng)計(jì),中藥和生物制品的品種數(shù)均以藥品通用名稱統(tǒng)計(jì),下同),較2017年增長(zhǎng)了21%。其中,受理1類創(chuàng)新藥的新藥臨床試驗(yàn)(IND)申請(qǐng)239個(gè)品種,較2017年增長(zhǎng)了15%;受理1類創(chuàng)新藥的新藥上市申請(qǐng)(NDA)25個(gè)品種,較2017年增長(zhǎng)了150%。
2018年,藥審中心受理1類化藥創(chuàng)新藥注冊(cè)申請(qǐng)共157個(gè)品種,其中,受理1類化藥創(chuàng)新藥NDA16個(gè)品種,較2017年增長(zhǎng)了100%。
2018年,藥審中心受理1-6類中藥新藥注冊(cè)申請(qǐng)共37個(gè)品種,其中,受理中藥NDA8個(gè)品種,較2017年增長(zhǎng)了7倍;受理中藥IND29個(gè)品種,且有1個(gè)品種為1類中藥創(chuàng)新藥IND申請(qǐng)。
2018年,藥審中心受理1類生物制品創(chuàng)新藥注冊(cè)申請(qǐng)106個(gè)品種(包括預(yù)防用生物制品6件,治療用生物制品117件,共涉及123件受理號(hào)),較2017年增長(zhǎng)了62%。其中,受理1類生物制品NDA9個(gè)品種(包括預(yù)防用生物制品2件,治療用生物制品9件,共涉及11件受理號(hào)),較2017年增長(zhǎng)了4.5倍。
(一)總體情況
2018年,藥審中心受理的7336件新注冊(cè)申請(qǐng)中,化藥注冊(cè)申請(qǐng)受理量為5979件,占2018年全部注冊(cè)申請(qǐng)受理量的82%,2018年各類藥品注冊(cè)申請(qǐng)受理情況與近三年比較詳見(jiàn)圖1。
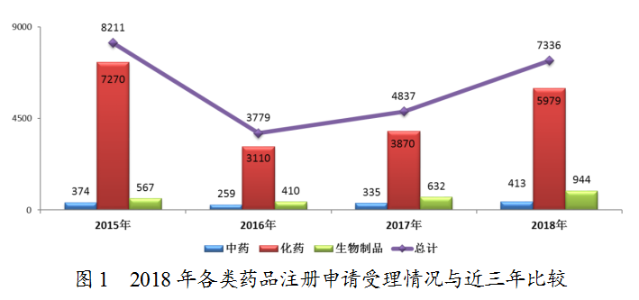
需技術(shù)審評(píng)的5574件注冊(cè)申請(qǐng)中,化藥為4459件,占全部需技術(shù)審評(píng)的注冊(cè)申請(qǐng)受理量的80%,中藥和生物制品注冊(cè)申請(qǐng)分別為300件和815件。
(二)國(guó)產(chǎn)創(chuàng)新藥受理情況
藥審中心受理國(guó)產(chǎn)1類創(chuàng)新藥注冊(cè)申請(qǐng)448件(涉及222個(gè)品種),其中受理臨床申請(qǐng)403件(涉及198個(gè)品種),上市申請(qǐng)45件(涉及24個(gè)品種)。按藥品類型統(tǒng)計(jì),化藥323件(涉及115個(gè)品種),中藥2件(涉及1個(gè)品種),生物制品123件(涉及106個(gè)品種),創(chuàng)新藥的適應(yīng)癥主要集中在抗腫瘤、內(nèi)分泌系統(tǒng)和消化系統(tǒng)領(lǐng)域。
(三)進(jìn)口藥受理情況
藥審中心受理5.1類化藥進(jìn)口原研藥注冊(cè)申請(qǐng)75件(涉及50個(gè)品種),受理1類進(jìn)口創(chuàng)新藥注冊(cè)申請(qǐng)85件(涉及42個(gè)品種),創(chuàng)新藥的適應(yīng)癥主要集中在抗腫瘤、循環(huán)系統(tǒng)和消化系統(tǒng)領(lǐng)域。
(四)各類注冊(cè)申請(qǐng)受理情況
1.化藥注冊(cè)申請(qǐng)受理情況
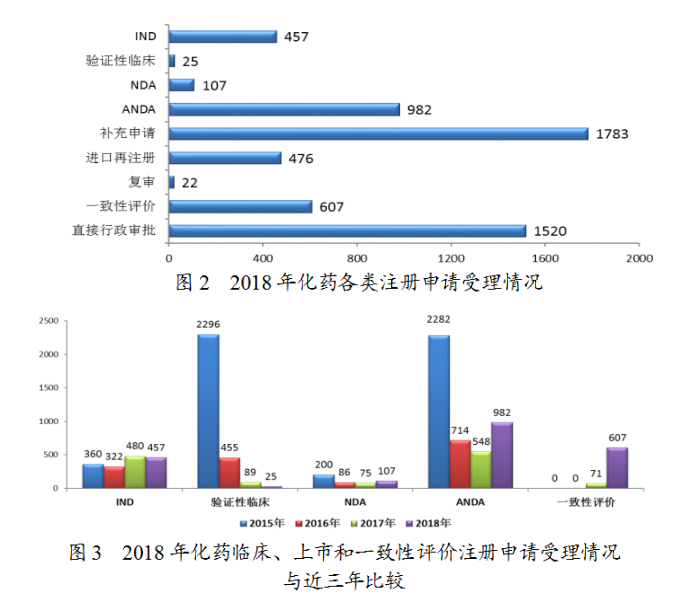
藥審中心受理化藥注冊(cè)申請(qǐng)共5979件,其中受理化藥NDA申請(qǐng)107件,較2017年增長(zhǎng)了43%;受理仿制藥上市申請(qǐng)(ANDA)982件,較2017年增長(zhǎng)了79%。化藥各類注冊(cè)申請(qǐng)受理情況詳見(jiàn)圖2。2018年化藥臨床、上市和一致性評(píng)價(jià)注冊(cè)申請(qǐng)受理情況與近三年比較詳見(jiàn)圖3。
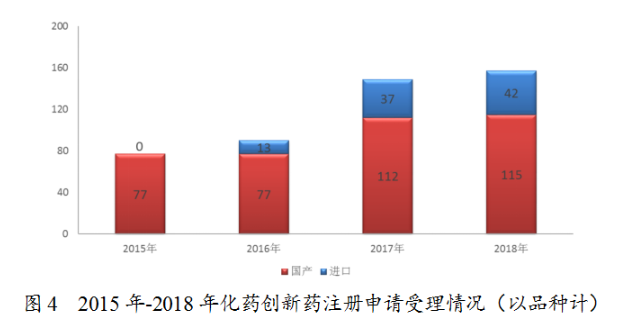
(1)創(chuàng)新藥受理情況
藥審中心受理1類化藥創(chuàng)新藥注冊(cè)申請(qǐng)157個(gè)品種,整體較2017年略有增加,其中受理創(chuàng)新藥NDA16個(gè)品種,較2017年增長(zhǎng)了一倍。2018年受理的157個(gè)化藥創(chuàng)新藥注冊(cè)申請(qǐng)中,國(guó)產(chǎn)化藥創(chuàng)新藥注冊(cè)申請(qǐng)為115個(gè)品種,進(jìn)口化藥創(chuàng)新藥注冊(cè)申請(qǐng)為42個(gè)品種,2015年至2018年創(chuàng)新藥注冊(cè)申請(qǐng)受理情況詳見(jiàn)圖4。
(2)化藥新藥臨床試驗(yàn)申請(qǐng)適應(yīng)癥
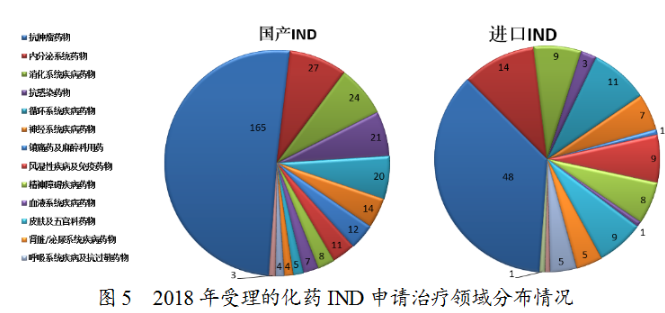
藥審中心受理化藥IND申請(qǐng)457件,其中受理國(guó)產(chǎn)化藥IND申請(qǐng)325件,受理進(jìn)口IND申請(qǐng)132件。國(guó)產(chǎn)化藥IND申請(qǐng)的適應(yīng)癥主要集中在抗腫瘤、內(nèi)分泌系統(tǒng)和消化系統(tǒng)領(lǐng)域。進(jìn)口IND申請(qǐng)的適應(yīng)癥主要集中在抗腫瘤、內(nèi)分泌系統(tǒng)和循環(huán)系統(tǒng)領(lǐng)域,具體治療領(lǐng)域分布詳見(jiàn)圖5。
2.中藥注冊(cè)申請(qǐng)受理情況
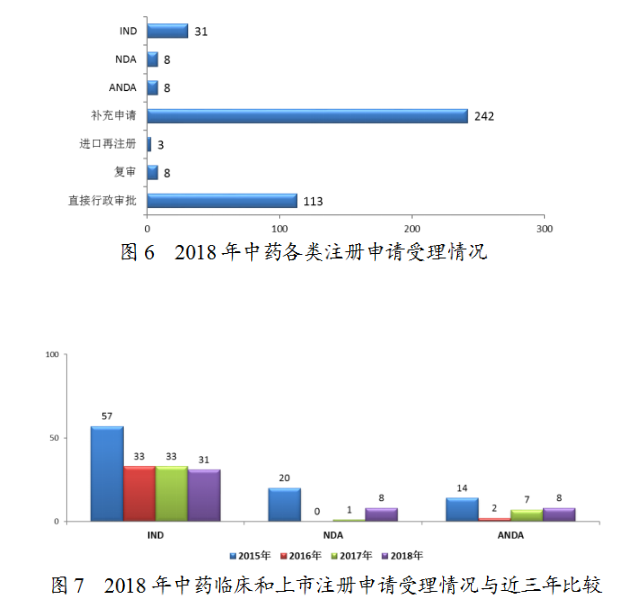
藥審中心受理中藥注冊(cè)申請(qǐng)413件,其中受理中藥IND申請(qǐng)31件,受理中藥NDA8件,受理中藥ANDA8件。中藥各類注冊(cè)申請(qǐng)受理情況詳見(jiàn)圖6。2018年中藥臨床和上市注冊(cè)申請(qǐng)受理情況與近三年比較詳見(jiàn)圖7。
(1)中藥新藥受理情況
藥審中心受理1-6類中藥新藥注冊(cè)申請(qǐng)39件,其中受理中藥NDA8件(涉及8個(gè)品種),較2017年增長(zhǎng)了7倍;中藥IND31件(涉及29個(gè)品種),其中1類中藥創(chuàng)新藥IND申請(qǐng)有2件(涉及1個(gè)品種)。
(2)中藥新藥臨床試驗(yàn)申請(qǐng)適應(yīng)癥
藥審中心受理中藥IND申請(qǐng)31件,主要治療領(lǐng)域?yàn)橄⑿难堋⒑粑途裆窠?jīng),占全部中藥IND申請(qǐng)的65%。
3.生物制品注冊(cè)申請(qǐng)受理情況
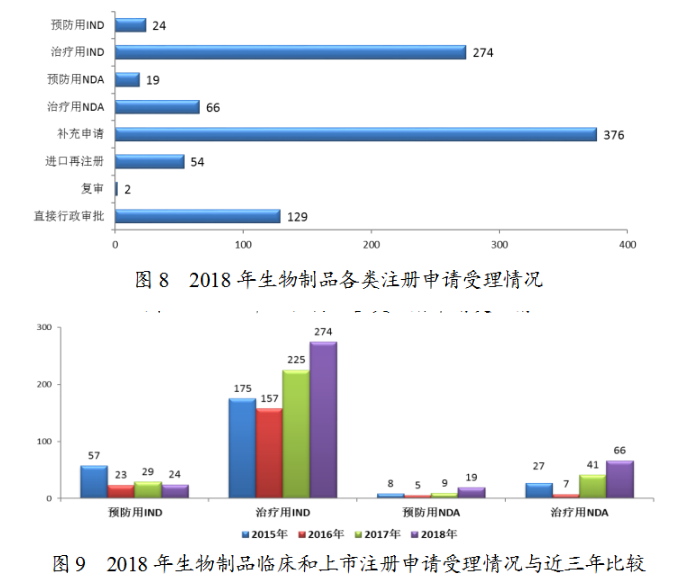
藥審中心受理生物制品注冊(cè)申請(qǐng)944件,其中受理生物制品IND申請(qǐng)298件;受理生物制品NDA85件,較2017年增長(zhǎng)了70%。生物制品各類注冊(cè)申請(qǐng)受理情況詳見(jiàn)圖8。2018年生物制品臨床和上市注冊(cè)申請(qǐng)受理情況與近三年比較詳見(jiàn)圖9。
(1)1類生物制品創(chuàng)新藥受理情況
藥審中心受理1類生物制品創(chuàng)新藥注冊(cè)申請(qǐng)123件(包括預(yù)防用生物制品6件,治療用生物制品117件),較2017年增長(zhǎng)了62%。其中,受理1類生物制品NDA11件(包括預(yù)防用生物制品2件,治療用生物制品9件,共涉及9個(gè)品種),較2017年增長(zhǎng)了4.5倍;受理1類生物制品IND112件(包括預(yù)防用生物制品4件,治療用生物制品108件,共涉及97個(gè)品種),較2017年增長(zhǎng)了51%。
(2)1類治療用生物制品創(chuàng)新藥臨床試驗(yàn)申請(qǐng)適應(yīng)癥
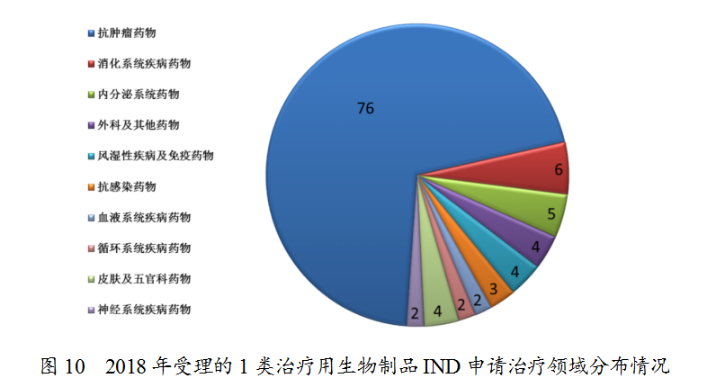
藥審中心受理1類治療用生物制品IND申請(qǐng)108件(涉及93個(gè)品種),適應(yīng)癥主要集中在抗腫瘤治療領(lǐng)域,占全部1類治療用生物制品IND申請(qǐng)的70%,具體治療領(lǐng)域分布詳見(jiàn)圖10。
二、藥品注冊(cè)申請(qǐng)審評(píng)審批情況
(一)審評(píng)審批總體完成情況
1.全年審評(píng)審批完成情況
2018年底,藥審中心實(shí)現(xiàn)中藥、化藥、生物制品各類注冊(cè)申請(qǐng)按時(shí)限審評(píng)審批率已超過(guò)90%,基本完成了44號(hào)文件確定2018年實(shí)現(xiàn)按規(guī)定時(shí)限審批的工作目標(biāo)。全年完成審評(píng)審批的注冊(cè)申請(qǐng)共9796件,其中完成需技術(shù)審評(píng)的注冊(cè)申請(qǐng)7988件(包含4052件需技術(shù)審評(píng)的行政審批任務(wù)),完成直接行政審批的注冊(cè)申請(qǐng)1808件。
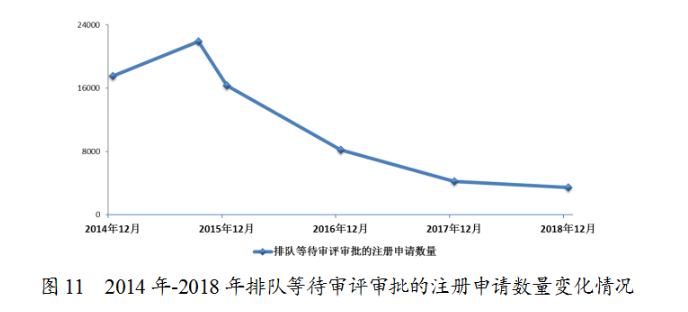
2018年底排隊(duì)等待審評(píng)審批的注冊(cè)申請(qǐng)已由2015年9月高峰時(shí)的近22000件降至3440件(不含完成審評(píng)因申報(bào)資料缺陷等待申請(qǐng)人回復(fù)補(bǔ)充資料的注冊(cè)申請(qǐng)),進(jìn)一步鞏固了44號(hào)文件要求解決注冊(cè)申請(qǐng)積壓的成效。2014年-2018年排隊(duì)等待審評(píng)審批的注冊(cè)申請(qǐng)數(shù)量變化情況詳見(jiàn)圖11。
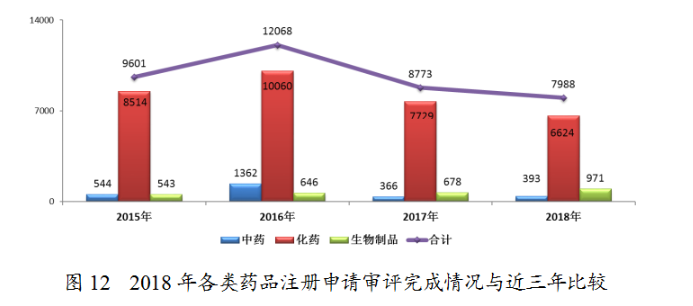
完成審評(píng)的申請(qǐng)中,化藥注冊(cè)申請(qǐng)為6624件,約占全部審評(píng)完成量的83%。2018年各類藥品注冊(cè)申請(qǐng)審評(píng)完成情況與近三年比較詳見(jiàn)圖12。
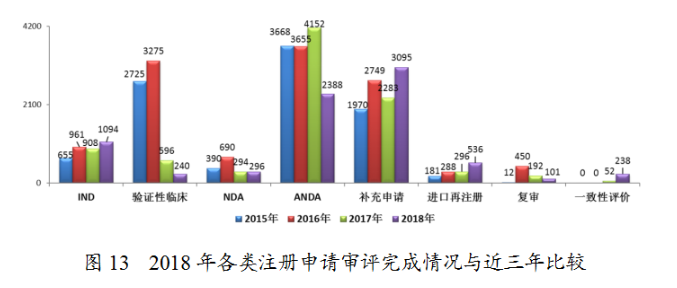
2.各類注冊(cè)申請(qǐng)審評(píng)完成情況
藥審中心完成IND申請(qǐng)審評(píng)1094件,完成NDA審評(píng)296件,完成ANDA審評(píng)2388件,2018年各類注冊(cè)申請(qǐng)審評(píng)完成情況與近三年比較詳見(jiàn)圖13。
3.審評(píng)通過(guò)情況
2018年,藥審中心審評(píng)通過(guò)批準(zhǔn)IND申請(qǐng)947件,審評(píng)通過(guò)(往年的年度審評(píng)報(bào)告中表述為“審評(píng)通過(guò)建議批準(zhǔn)”,下同)NDA175件,審評(píng)通過(guò)ANDA1038件。
審評(píng)通過(guò)上市1類創(chuàng)新藥9個(gè)品種,審評(píng)通過(guò)進(jìn)口原研藥67個(gè)品種,具體品種詳見(jiàn)附件1、2。
(二)化藥注冊(cè)申請(qǐng)審評(píng)完成情況
1.總體情況
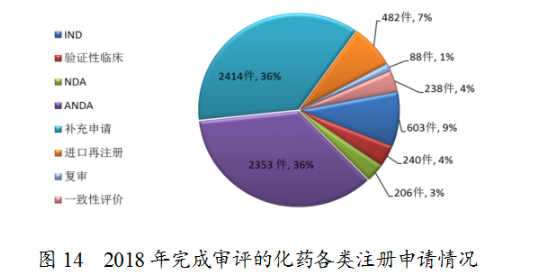
藥審中心完成審評(píng)的化藥注冊(cè)申請(qǐng)6624件,其中完成化藥臨床申請(qǐng)(IND和驗(yàn)證性臨床)共843件,完成化藥NDA206件,完成化藥ANDA2353件。完成審評(píng)的化藥各類注冊(cè)申請(qǐng)情況詳見(jiàn)圖14。
2.審評(píng)通過(guò)情況
藥審中心完成審評(píng)的化藥NDA206件,其中審評(píng)通過(guò)132件,與前三年比較(以受理號(hào)計(jì))詳見(jiàn)圖15,2018年完成審評(píng)的化藥各類注冊(cè)申請(qǐng)具體情況詳見(jiàn)表1。

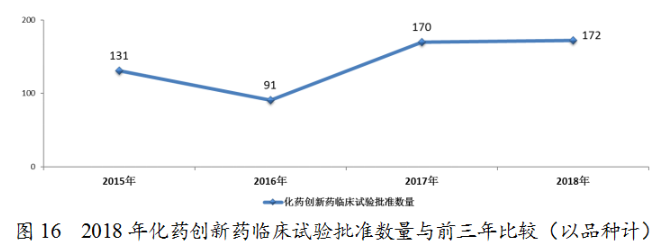
藥審中心完成審評(píng)的化藥IND申請(qǐng)603件,審評(píng)通過(guò)批準(zhǔn)IND申請(qǐng)554件,其中批準(zhǔn)1類創(chuàng)新藥臨床試驗(yàn)申請(qǐng)449件(涉及172個(gè)品種)。1類化藥創(chuàng)新藥臨床試驗(yàn)批準(zhǔn)數(shù)量與前三年比較(以品種計(jì))詳見(jiàn)圖16。
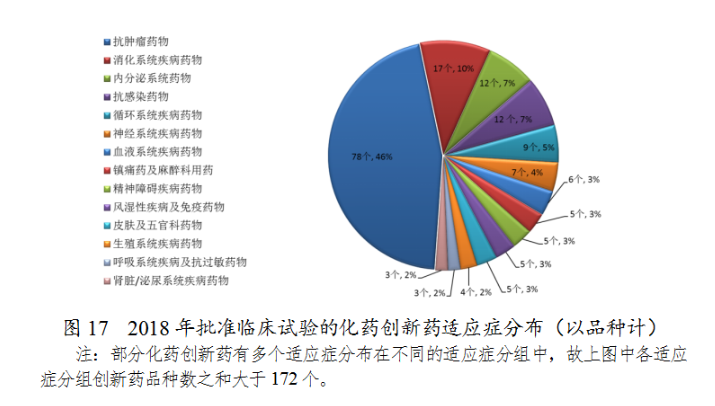
藥審中心審評(píng)通過(guò)批準(zhǔn)創(chuàng)新藥臨床試驗(yàn)的172個(gè)品種中,抗腫瘤藥物、消化系統(tǒng)藥物、內(nèi)分泌系統(tǒng)藥物和抗感染藥物較多,占全部創(chuàng)新藥臨床試驗(yàn)批準(zhǔn)數(shù)量的68%。批準(zhǔn)臨床試驗(yàn)的化藥創(chuàng)新藥適應(yīng)癥分布(以品種計(jì))詳見(jiàn)圖17。
(三)中藥注冊(cè)申請(qǐng)審評(píng)完成情況
1.總體情況
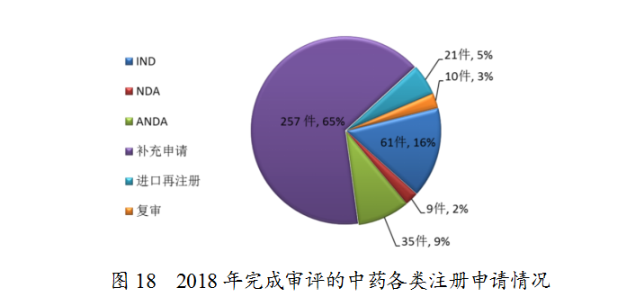
藥審中心完成審評(píng)的中藥注冊(cè)申請(qǐng)393件,其中完成IND申請(qǐng)61件,完成NDA9件,完成ANDA35件。完成審評(píng)的中藥各類注冊(cè)申請(qǐng)情況詳見(jiàn)圖18。
2.審評(píng)通過(guò)情況
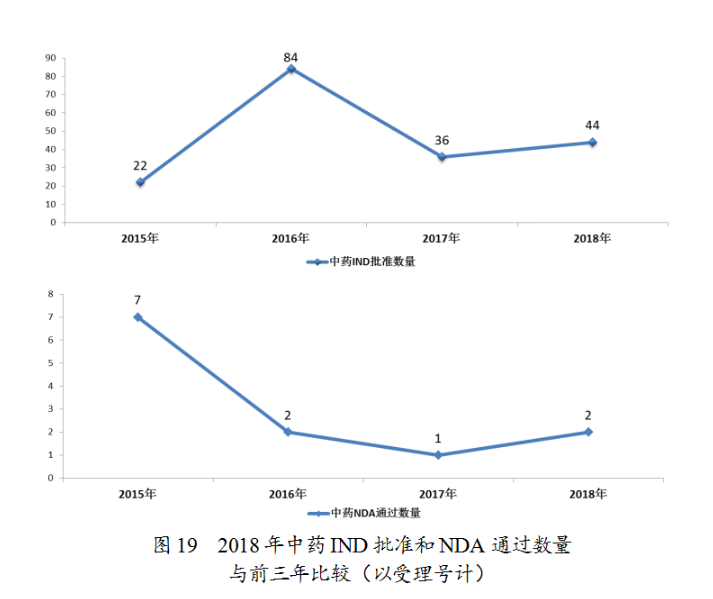
藥審中心審評(píng)通過(guò)批準(zhǔn)中藥IND申請(qǐng)44件;審評(píng)通過(guò)中藥NDA2件(涉及2個(gè)品種,關(guān)黃母顆粒、金蓉顆粒)。完成審評(píng)的中藥各類注冊(cè)申請(qǐng)具體情況詳見(jiàn)表2,中藥IND批準(zhǔn)和NDA通過(guò)量與前三年比較(以受理號(hào)計(jì))詳見(jiàn)圖19。
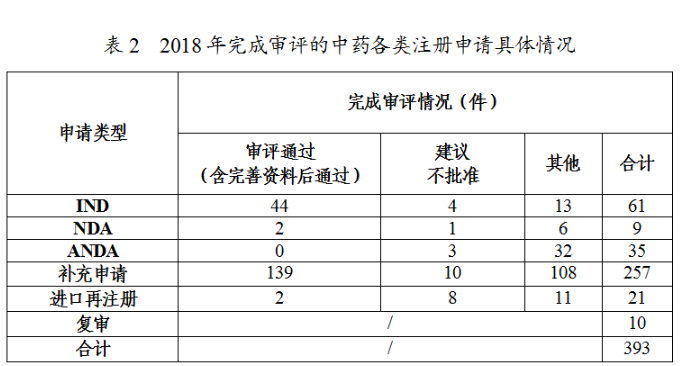
藥審中心審評(píng)通過(guò)批準(zhǔn)臨床試驗(yàn)的中藥IND申請(qǐng)44件,涉及10個(gè)適應(yīng)癥領(lǐng)域,其中心血管、精神神經(jīng)、呼吸較多,共占48%,具體治療領(lǐng)域分布詳見(jiàn)圖20。
(四)生物制品注冊(cè)申請(qǐng)審評(píng)完成情況
1.總體情況
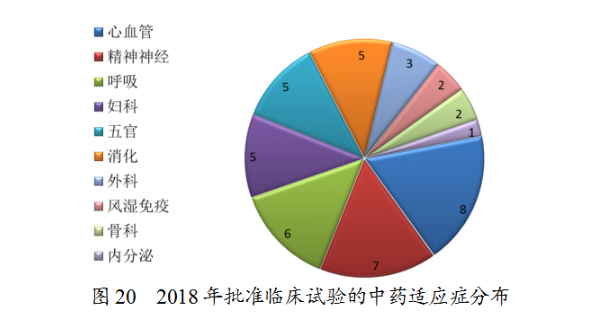
藥審中心完成審評(píng)的生物制品注冊(cè)申請(qǐng)共971件,其中完成預(yù)防用生物制品IND申請(qǐng)(預(yù)防用IND)53件,完成治療用生物制品IND申請(qǐng)(治療用IND)377件,完成預(yù)防用生物制品NDA(預(yù)防用NDA)18件,完成治療用生物制品NDA(治療用NDA)63件。完成審評(píng)的生物制品各類注冊(cè)申請(qǐng)情況詳見(jiàn)圖21。
2.審評(píng)通過(guò)情況
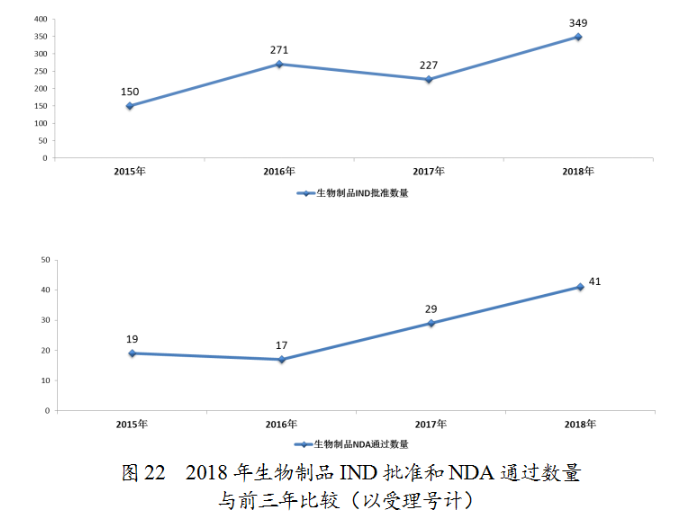
藥審中心審評(píng)通過(guò)批準(zhǔn)預(yù)防用IND33件,批準(zhǔn)治療用IND316件;審評(píng)通過(guò)預(yù)防用NDA11件、治療用NDA30件。2018年完成審評(píng)的生物制品各類注冊(cè)申請(qǐng)具體情況詳見(jiàn)表3,生物制品IND批準(zhǔn)和NDA通過(guò)量與前三年比較(以受理號(hào)計(jì))詳見(jiàn)圖22。
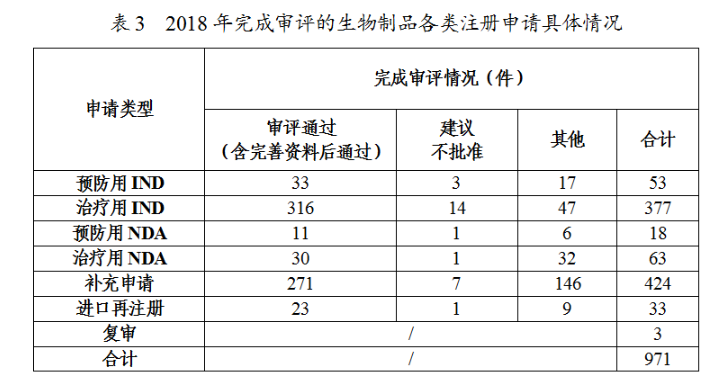
藥審中心審評(píng)通過(guò)批準(zhǔn)生物制品IND349件,其中批準(zhǔn)的治療用生物制品IND治療領(lǐng)域分布詳見(jiàn)圖23。
(五)行政審批任務(wù)完成情況
2018年,藥審中心共完成行政審批任務(wù)5860件,其中,完成無(wú)需技術(shù)審評(píng)的直接行政審批任務(wù)(即無(wú)需技術(shù)審評(píng)的補(bǔ)充申請(qǐng))1808件,平均審批時(shí)限為12.3個(gè)工作日,遠(yuǎn)小于法定的20日行政審批時(shí)限,其中有1656件任務(wù)在法定的20日時(shí)限內(nèi)完成,全年平均按時(shí)限完成率為92%;完成需技術(shù)審評(píng)品種的行政審批任務(wù)(即臨床申請(qǐng)、進(jìn)口再注冊(cè)申請(qǐng)、需技術(shù)審評(píng)的補(bǔ)充申請(qǐng)等)4052件,平均審批時(shí)限為18.6個(gè)工作日,小于法定的20日行政審批時(shí)限,全年平均按時(shí)限審批完成率為84%。(注:上述4052件需技術(shù)審評(píng)的行政審批任務(wù),不包括原輔包關(guān)聯(lián)審評(píng)審批實(shí)施前已受理完成審評(píng)后轉(zhuǎn)原輔包登記平臺(tái)管理的注冊(cè)申請(qǐng)任務(wù))。
(六)優(yōu)先審評(píng)納入情況
1.優(yōu)先審評(píng)品種納入情況
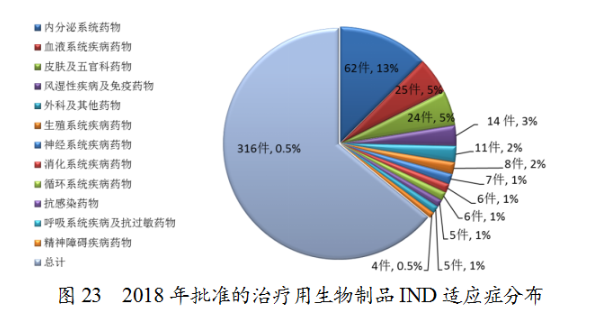
根據(jù)國(guó)家食品藥品監(jiān)督管理總局(以下簡(jiǎn)稱原總局)《關(guān)于鼓勵(lì)藥品創(chuàng)新實(shí)行優(yōu)先審評(píng)審批的意見(jiàn)》(食藥監(jiān)藥化管〔2017〕126號(hào)),2018年,藥審中心共將313件注冊(cè)申請(qǐng)納入優(yōu)先審評(píng)程序,其中兒童用藥和罕見(jiàn)病用藥63件。2018年納入優(yōu)先審評(píng)的注冊(cè)申請(qǐng)中,同步申報(bào)的品種占比最大,占比為28%,其次為具有明顯臨床價(jià)值的新藥,占比為23%。納入優(yōu)先審評(píng)程序的注冊(cè)申請(qǐng)情況詳見(jiàn)圖24。
2.優(yōu)先審評(píng)品種審評(píng)完成情況
2018年,共有83個(gè)品種通過(guò)優(yōu)先審評(píng)程序得以加快批準(zhǔn)上市(以通用名計(jì)算),如自主研發(fā)的注射用艾博韋泰、口服丙肝治療用新藥達(dá)諾瑞韋鈉片、治療晚期結(jié)直腸癌的小分子血管生成抑制劑呋喹替尼膠囊等藥品,具體品種名單詳見(jiàn)附件3。
(七)溝通交流情況
1.溝通交流總體情況
為進(jìn)一步為申請(qǐng)人提供便利,藥審中心不斷豐富溝通交流渠道,提高溝通交流效率和質(zhì)量,形成了溝通交流會(huì)議、網(wǎng)絡(luò)平臺(tái)咨詢(一般性技術(shù)問(wèn)題)、電話咨詢、郵件咨詢和現(xiàn)場(chǎng)咨詢的多渠道、多層次的溝通交流模式。2018年藥審中心接收溝通交流申請(qǐng)1982件,較2017年的840件增長(zhǎng)了136%;接收網(wǎng)絡(luò)平臺(tái)咨詢15219個(gè),較2017年的5881個(gè)增長(zhǎng)了159%,電話咨詢超過(guò)上萬(wàn)次,郵件咨詢數(shù)千次,同時(shí)每周三定期開(kāi)展現(xiàn)場(chǎng)咨詢。2017至2018年網(wǎng)絡(luò)平臺(tái)咨詢和溝通交流申請(qǐng)具體情況見(jiàn)圖25。
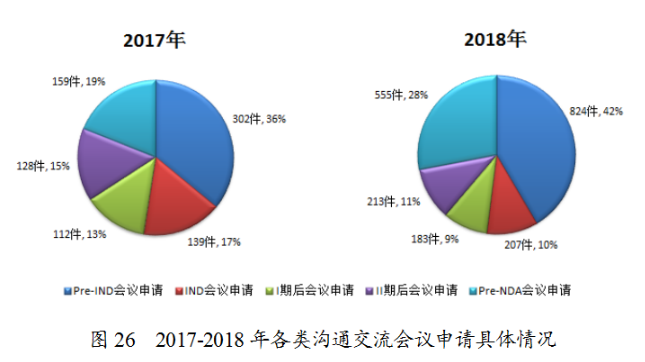
2.溝通交流會(huì)召開(kāi)情況
2018年收到溝通交流會(huì)議申請(qǐng)1982件,其中Pre-IND會(huì)議申請(qǐng)和Pre-NDA會(huì)議申請(qǐng)占比例較多,分別為42%和28%。與2017年比較,Pre-IND會(huì)議申請(qǐng)和Pre-NDA會(huì)議申請(qǐng)所占比例增長(zhǎng)較明顯,2017至2018年各類溝通交流會(huì)議申請(qǐng)具體情況見(jiàn)圖26。
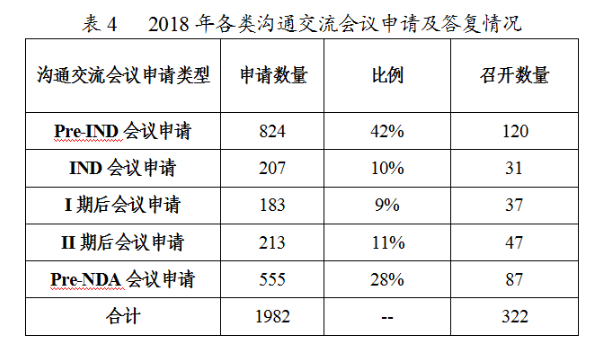
根據(jù)申請(qǐng)人擬溝通的問(wèn)題及提交的支持性材料,經(jīng)審核評(píng)估,2018年藥審中心召開(kāi)溝通交流會(huì)322次,其余均以書面形式進(jìn)行了答復(fù),2018年各類溝通交流會(huì)議申請(qǐng)及答復(fù)情況詳見(jiàn)表4。
三、鼓勵(lì)創(chuàng)新與保障公眾用藥情況
(一)加快審評(píng)重點(diǎn)品種
2018年,藥審中心在進(jìn)一步鞏固解決注冊(cè)申請(qǐng)積壓成效和基本實(shí)現(xiàn)各類藥品注冊(cè)申請(qǐng)按法定時(shí)限審評(píng)審批的基礎(chǔ)上,通過(guò)實(shí)施優(yōu)先審評(píng)程序、加強(qiáng)與申請(qǐng)人的溝通交流等措施,一批具有明顯臨床價(jià)值、臨床急需等新藥好藥通過(guò)技術(shù)審評(píng),為患者提供了更多用藥選擇。
2018年,藥審中心審評(píng)通過(guò)的新藥(NDA及IND直接批產(chǎn))106個(gè)(按品種統(tǒng)計(jì)),包含關(guān)黃母顆粒、金蓉顆粒2個(gè)新中藥復(fù)方制劑,以及9個(gè)1類創(chuàng)新藥和67個(gè)進(jìn)口原研藥(詳見(jiàn)附件1、2)。1類創(chuàng)新藥全部為我國(guó)自主創(chuàng)新藥品且以抗癌藥、抗病毒藥居多,分別是呋喹替尼膠囊、羅沙司他膠囊、馬來(lái)酸吡咯替尼片、鹽酸安羅替尼膠囊、達(dá)諾瑞韋鈉片、注射用艾博韋泰6個(gè)化學(xué)新分子實(shí)體藥物,特瑞普利單抗注射液、信迪利單抗注射液2個(gè)抗PD-1單克隆抗體,以及重組細(xì)胞因子基因衍生蛋白注射液。
2018年藥審中心審評(píng)通過(guò)的重點(diǎn)品種有:
抗腫瘤藥物:
1.呋喹替尼膠囊,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)小分子多靶點(diǎn)抗血管生成藥物,適用于治療經(jīng)過(guò)含氟尿嘧啶和鉑類化療后進(jìn)展的晚期結(jié)直腸癌,該藥品為晚期腸癌患者提供了更好的治療手段。
2.鹽酸安羅替尼膠囊,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)小分子多靶點(diǎn)抗血管生成藥物,適用于治療既往經(jīng)過(guò)兩種系統(tǒng)方案化療后出現(xiàn)進(jìn)展或復(fù)發(fā)的晚期非小細(xì)胞肺癌,該藥品為晚期肺癌患者提供了新的治療選擇。
3.馬來(lái)酸吡咯替尼片,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)人表皮生長(zhǎng)因子受體2(HER-2)小分子酪氨酸激酶抑制劑,適用于治療HER-2陽(yáng)性轉(zhuǎn)移性乳腺癌,該藥品滿足了HER-2陽(yáng)性晚期乳腺癌患者迫切的臨床需求。
4.特瑞普利單抗注射液,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)首個(gè)新型抗腫瘤藥物抗PD-1單克隆抗體,適用于治療既往接受全身系統(tǒng)治療失敗的不可切除或轉(zhuǎn)移性黑色素瘤,該藥品滿足了晚期黑色素瘤患者迫切的臨床需求。
5.信迪利單抗注射液,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)首個(gè)適用于治療至少經(jīng)過(guò)二線系統(tǒng)化療的復(fù)發(fā)或難治性經(jīng)典型霍奇金淋巴瘤的新型抗腫瘤藥物抗PD-1單克隆抗體。目前,全球同類產(chǎn)品有納武利尤單抗注射液和帕博利珠單抗注射液,我國(guó)批準(zhǔn)用于治療非小細(xì)胞肺癌、黑色素瘤,但尚未批準(zhǔn)其用于治療淋巴瘤,該藥品滿足了國(guó)內(nèi)患者的臨床需求。
6.帕博利珠單抗注射液,為新型抗腫瘤藥物抗PD-1單克隆抗體,適用于治療一線治療失敗后不可切除或轉(zhuǎn)移性黑色素瘤,該藥品為晚期黑色素瘤患者提供了新的治療手段。
7.納武利尤單抗注射液,為國(guó)內(nèi)首個(gè)新型抗腫瘤藥物抗PD-1單克隆抗體,適用于治療經(jīng)過(guò)含鉑化療后疾病進(jìn)展的轉(zhuǎn)移性非小細(xì)胞肺癌,該藥品為晚期肺癌患者提供了更優(yōu)的治療選擇。
8.鹽酸阿來(lái)替尼膠囊,為第二代小分子ALK抑制劑,適用于治療ALK融合基因陽(yáng)性的轉(zhuǎn)移性非小細(xì)胞肺癌。該藥品與現(xiàn)有標(biāo)準(zhǔn)治療相比,具有顯著的生存獲益(無(wú)進(jìn)展生存期從11個(gè)月提高到34.8個(gè)月),為ALK陽(yáng)性晚期肺癌患者提供了突破性的治療選擇。
抗感染藥物:
9.索磷布韋維帕他韋片,為國(guó)內(nèi)首個(gè)第三代泛基因型直接抗慢性丙型肝炎病毒(HCV)感染的口服復(fù)方制劑,適用于治療基因1至6型、混合型和未知型HCV感染,治愈率高達(dá)98%。該藥品已入選國(guó)家基本藥物目錄,為我國(guó)徹底消滅慢性丙型肝炎提供了有力武器。
10.來(lái)迪派韋索磷布韋片,為第二代直接抗HCV感染口服復(fù)方制劑,具有廣譜抗HCV病毒作用,適用于治療基因1、4、5、6型HCV感染,該藥品為我國(guó)慢性丙型肝炎患者提供更多的治愈機(jī)會(huì)。
11.達(dá)諾瑞韋鈉片,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)首個(gè)抗HCV口服制劑,適用于與其他藥物聯(lián)合使用,治療初治的非肝硬化的基因1型慢性丙型肝炎。該藥品填補(bǔ)了國(guó)內(nèi)該領(lǐng)域的空白,可降低用藥成本,滿足HCV患者用藥可及性。
12.注射用艾博韋泰,為具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)首個(gè)抗艾滋病藥物,適用于與其它藥物聯(lián)合使用,治療已接受過(guò)抗病毒藥物治療的人類免疫缺陷病毒-1(HIV-1)感染。該藥品上市填補(bǔ)了國(guó)內(nèi)該領(lǐng)域的空白,為艾滋病患者提供了新的安全有效的治療選擇。
13.泊沙康唑腸溶片,為咪唑類抗真菌藥物,適用于預(yù)防13歲和13歲以上患者因重度免疫缺陷而導(dǎo)致侵襲性曲霉菌和念珠菌感染風(fēng)險(xiǎn)增加。目前,深部真菌感染已成為導(dǎo)致癌癥、造血干細(xì)胞移植、艾滋病等免疫系統(tǒng)受損患者死亡的主要原因,該藥品為深部真菌感染的預(yù)防與治療提供了新的選擇。
循環(huán)系統(tǒng)藥物:
14.甲苯磺酸艾多沙班片,為新型抗凝藥物,適用于預(yù)防伴有一個(gè)或多個(gè)風(fēng)險(xiǎn)因素的非瓣膜性房顫患者的卒中和體循環(huán)栓塞,以及治療深靜脈血栓和肺栓塞以及預(yù)防其復(fù)發(fā)。該藥品與現(xiàn)有治療手段相比,可降低出血風(fēng)險(xiǎn),為上述患者提供了更優(yōu)的治療選擇。
15.依洛尤單抗注射液,為國(guó)內(nèi)首個(gè)遺傳性罕見(jiàn)病純合子型家族性高膽固醇血癥(HoFH)單克隆抗體,適用于與飲食療法和其他藥物聯(lián)合使用治療HoFH,降低密度脂蛋白膽固醇(LDL-C)。現(xiàn)有降脂療法不能有效降低LDL-C,該藥品為常規(guī)治療療效不佳或者不耐受的血脂異常患者提供了新的治療手段。
16.司來(lái)帕格片,為國(guó)內(nèi)首個(gè)肺動(dòng)脈高壓(PAH)前列環(huán)素類口服制劑,適用于治療PAH以延緩疾病進(jìn)展及降低因PAH而住院的風(fēng)險(xiǎn)。目前,PAH仍是一種嚴(yán)重威脅生命的疾病,國(guó)內(nèi)可選擇的特異性治療藥物很少,該藥品與同類藥物相比,在給藥方式和耐受性方面更具優(yōu)勢(shì),滿足了肺動(dòng)脈高壓患者迫切的臨床需求。
血液系統(tǒng)藥物:
17.依庫(kù)珠單抗注射液,為補(bǔ)體蛋白C5特異性抗體,適用于治療罕見(jiàn)病陣發(fā)性睡眠性血紅蛋白尿癥(PNH)和非典型溶血性尿毒癥綜合征(aHUS)。該藥品是全球唯一獲批治療PNH溶血的藥物,為挽救aHUS患者的生命帶來(lái)突破性改變,屬于臨床急需產(chǎn)品,對(duì)于改善我國(guó)PNH和aHUS患者的生存現(xiàn)狀具有重大意義。
18.羅沙司他膠囊,為全球首個(gè)獲批上市具有自主知識(shí)產(chǎn)權(quán)的國(guó)產(chǎn)低氧誘導(dǎo)因子脯氨酸羥化酶(HIF-PH)抑制劑,適用于治療正在接受透析治療的患者因慢性腎臟病引起的貧血。該藥品具有全新作用機(jī)制,與現(xiàn)有常規(guī)治療藥物相比,可口服給藥,在提高鐵利用率、無(wú)需靜脈補(bǔ)鐵等方面具有臨床優(yōu)勢(shì)。
神經(jīng)系統(tǒng)藥物:
19.拉考沙胺片,為新型抗癲癇藥物,適用于16歲及以上癲癇患者部分性發(fā)作的聯(lián)合治療。該藥品與傳統(tǒng)抗癲癇藥物相比,具有耐藥性良好、有效性高、不良反應(yīng)少的特點(diǎn),可滿足癲癇患者的臨床需求。
20.特立氟胺片,為抑制T細(xì)胞增殖的新型口服免疫調(diào)節(jié)劑,適用于治療復(fù)發(fā)型多發(fā)性硬化癥。多發(fā)性硬化癥是一種終身、慢性、進(jìn)展性的自身免疫性罕見(jiàn)病,導(dǎo)致中樞神經(jīng)系統(tǒng)的功能性障礙,該藥品與傳統(tǒng)治療藥物相比,耐受性良好,為多發(fā)性硬化癥患者提供了更優(yōu)選擇。
預(yù)防用生物制品(疫苗):
21.九價(jià)人乳頭瘤病毒疫苗(釀酒酵母),適用于預(yù)防所包含HPV型別引起的宮頸癌、癌前病變、不典型病變以及持續(xù)感染,該藥品滿足了中國(guó)女性對(duì)九價(jià)HPV疫苗的臨床需求。目前全球已上市使用的所有HPV疫苗品種在我國(guó)均有供應(yīng),能更好地滿足公眾對(duì)疫苗接種的不同需求,為宮頸癌的預(yù)防提供了新的有效手段。
中藥新藥:
22.關(guān)黃母顆粒,為新的中藥復(fù)方制劑,適用于治療更年期綜合征肝腎陰虛證。與已上市的中藥相比,該藥品在改良Kupperman量表評(píng)分的改善等有效性方面有一定臨床優(yōu)勢(shì),為更年期綜合征女性患者的臨床治療提供了一種更為安全有效的治療選擇。
23.金蓉顆粒,為新的中藥復(fù)方制劑,適用于治療乳腺增生病痰瘀互結(jié)沖任失調(diào)證。該藥品為乳腺增生病患者提供了一種新的中醫(yī)證型的安全有效治療手段,對(duì)于滿足患者需求和解決臨床可及性具有積極意義。
重大公共衛(wèi)生用藥:
24.四價(jià)流感病毒裂解疫苗,為國(guó)內(nèi)首家適用于預(yù)防相關(guān)型別的流感病毒引起的流行性感冒疫苗。2017年-2018年流感流行季出現(xiàn)的大量流感病例,四價(jià)流感疫苗的上市為2018年-2019年流感季的預(yù)防接種提供了保障。
25.口服I型III型脊髓灰質(zhì)炎減毒活疫苗(人二倍體細(xì)胞),適用于預(yù)防脊髓灰質(zhì)炎I型和III型病毒導(dǎo)致的脊髓灰質(zhì)炎。自我國(guó)全面停用三價(jià)脊髓灰質(zhì)炎減毒活疫苗后,可用于與脊髓灰質(zhì)炎滅活疫苗(IPV)序貫接種的二價(jià)脊灰減毒活疫苗存在較為嚴(yán)重的供應(yīng)短缺問(wèn)題,該藥